1. Introducción
El cáncer de cuello uterino es el cuarto cáncer más común en las mujeres. Más de medio millón de mujeres son diagnosticadas anualmente debido a la infección persistente por el virus del papiloma humano (VPH), con una mortalidad de hasta 311,000.
Según el Fondo Mundial para la Investigación del Cáncer, los países en desarrollo tienen el 84% de la carga mundial de morbilidad y el 80% de la mortalidad debido a la falta de programas de detección efectivos.
Esto hace que el cáncer de cuello uterino sea un ejemplo de inequidad en salud global, ya que la enfermedad de progresión lenta proporciona tiempo para detectar y tratar lesiones precancerosas. Muchas mujeres en países de ingresos bajos y medianos (PIBM) buscan atención clínica una vez que experimentan síntomas persistentes de cáncer. Por el contrario, los programas de detección del cáncer de cuello uterino en los países de ingresos altos han ayudado a reducir significativamente la mortalidad.
Se han desarrollado e implementado varias técnicas de detección para ayudar en la detección del cuello uterino de bajos recursos.
1.1. Anatomía del cuello uterino
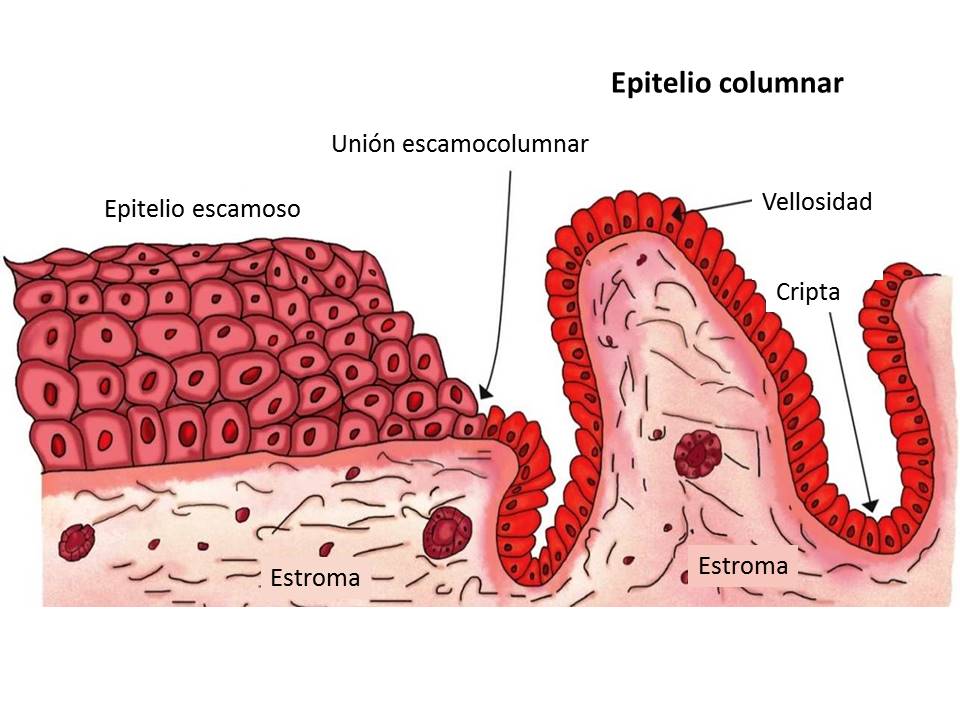
El cuello uterino es una estructura cilíndrica que conecta el canal vaginal (ectocérvix) con el útero (endocérvix). Mide 2-3 cm de largo, compuesto principalmente de epitelio y estroma. Hay dos tipos principales de epitelios presentes en el cuello uterino: escamoso cilíndrico y estratificado. El epitelio cilíndrico es el revestimiento que se encuentra en el endocérvix y secreta moco. El epitelio escamoso estratificado se encuentra en el ectocérvix y es una continuación del epitelio vaginal. La ubicación donde se encuentran estos dos epitelios se llama unión escamoso-cilíndrica (SCJ). La ubicación de la ATM varía según la remodelación cervical continua, siendo los factores principales la edad y las hormonas (por ejemplo, la ATM se encuentra en el orificio externo en mujeres más jóvenes).
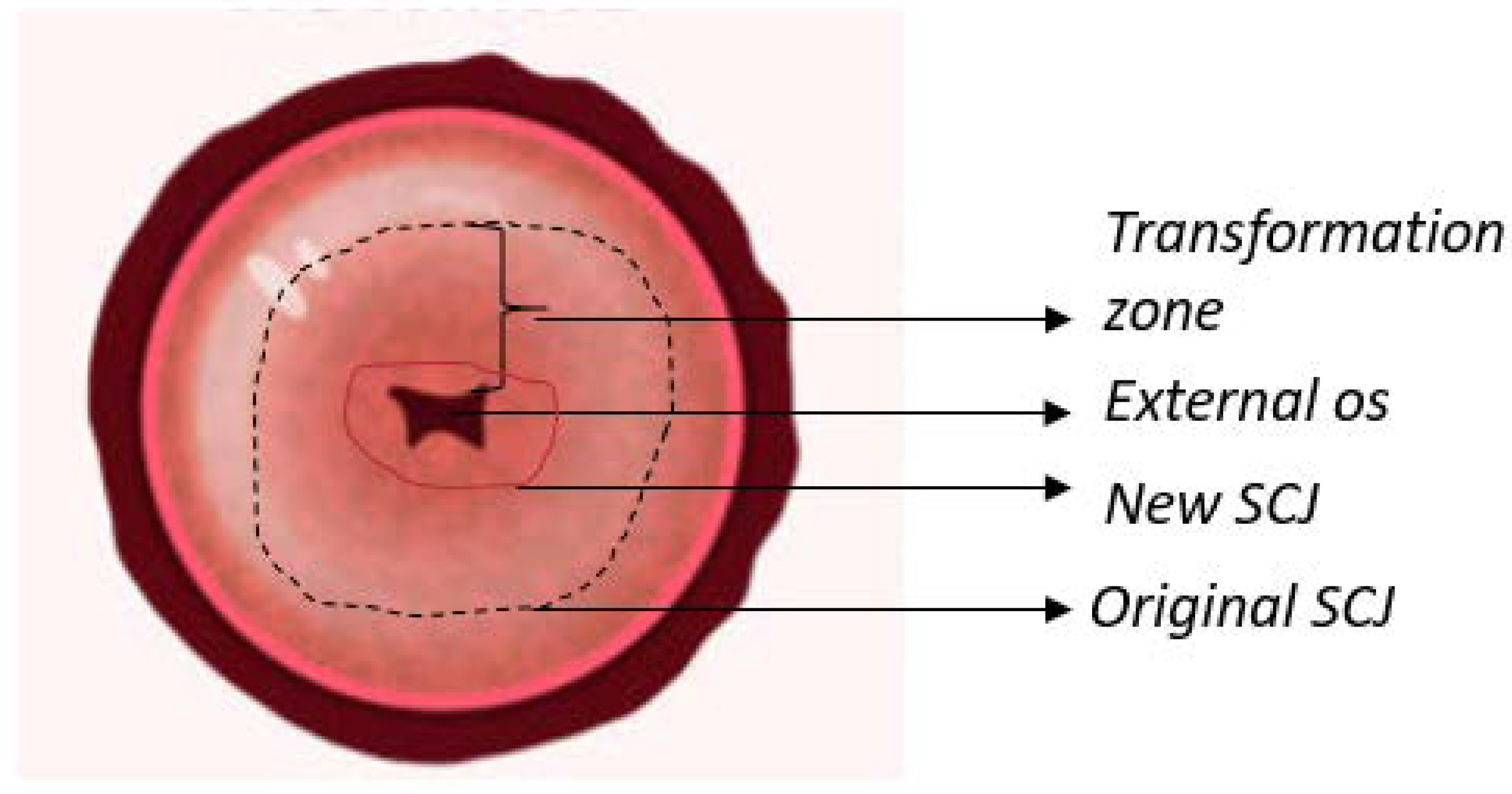
[6]. La Figura 1 ilustra una representación anatómica del cuello uterino.
Figura 1. Anatomía del cuello uterino destacando el epitelio que se encuentra en la superficie, así como la zona de transformación y la unión escamoso-cilíndrica (SCJ).La infección por VPH es la principal causa de cáncer de cuello uterino. Los tipos 16 y 18 son responsables del 71% de los casos; sin embargo, cuando se incluyen los tipos de VPH 4, 11, 16, 18, 31, 33, 45, 52 y 58, el porcentaje de casos de cáncer de cuello uterino debido al VPH aumenta al 90%. El VPH es una familia de virus de ADN (aproximadamente 15 que pueden infectar el tracto genital) que se dirigen a las células epiteliales basales y causan lesiones benignas y malignas.
El cuello uterino contiene una capa gruesa de estroma debajo de ambos tipos epiteliales, principalmente tejidos musculares, elásticos y fibrosos. El estroma fibroso ocupa tres áreas con orientaciones únicas que rodean el canal cervical. El canal interno y el cuello uterino externo están compuestos de colágeno alineado longitudinalmente, y en el medio se puede encontrar colágeno alineado circunferencialmente .
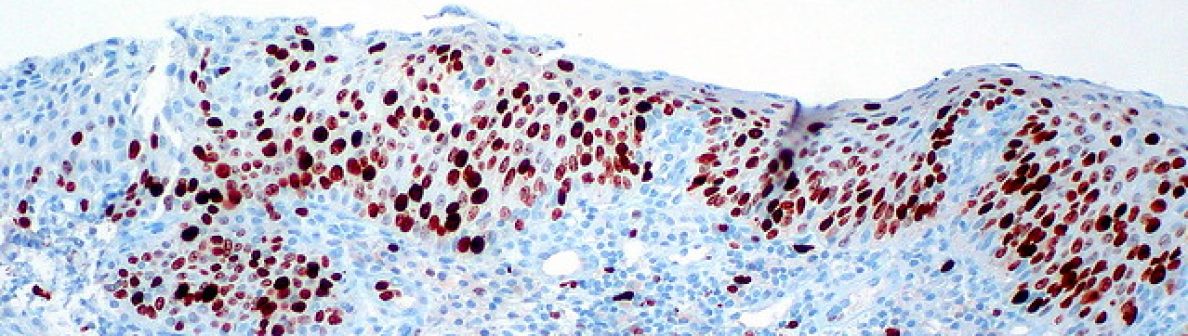
Los cánceres comunes incluyen células escamosas, adenocarcinomas, sarcomas y tumores neuroendocrinos de células pequeñas. El sistema inmunológico elimina la mayoría de las infecciones; si no, el virus procede a atacar las células de la SCJ cervical.
La infección persistente puede propagarse y atravesar la membrana basal para convertirse en un cáncer invasivo .
1.2. Progresión de la enfermedad
Durante la progresión de la enfermedad, tres tipos de estados neoplásicos afectan el epitelio. La neoplasia intraepitelial cervical (NIC) de primer grado o NIC 1 afecta a un tercio del epitelio y se considera leve y probablemente causada por una infección transitoria por VPH, que debería desaparecer de forma natural. La NIC 2, que afecta a dos tercios del epitelio, es un caso moderado y una combinación de autoeliminación y lesiones precancerosas. La NIC 3 se considera grave ya que afecta a todo el epitelio; Es un estado precanceroso ya que es poco probable que las lesiones desaparezcan de forma natural. Con el sistema Bethesda (sistema de clasificación utilizado para el diagnóstico citológico y las decisiones de tratamiento), la NIC 1 es una lesión intraepitelial escamosa de grado bajo (LSIL) y las NIC 2 y 3 son lesiones intraepiteliales escamosas de grado alto (HSIL). El cáncer de cuello uterino invasivo es una enfermedad de progresión lenta, que generalmente tarda más de diez años en desarrollarse completamente a partir de una infección .
La neoplasia cervical está relacionada con cambios tanto en el estroma como en las células epiteliales.
Los cambios estromales estimulan y preceden a la progresión neoplásica. Además, la carcinogénesis es el resultado de una comunicación defectuosa entre el epitelio y el estroma.
La matriz extracelular (MEC) puede regular el crecimiento, la muerte, la expresión génica y la migración, entre otros procesos, todos los cuales regulan procesos fisiológicos como la angiogénesis, la morfogénesis tisular, el desarrollo embrionario y los procesos patológicos. Además, el estroma y las células tumorales pueden intercambiar factores de crecimiento para activar la ECM vecina y ayudar a la expansión de las células neoplásicas.
La desregulación entre la comunicación del estroma y el epitelio promueve la carcinogénesis .
La progresión neoplásica da lugar a cambios en el estroma y, por lo tanto, en la matriz de colágeno, lo que conduce a cambios en la dispersión estromal y puede utilizarse para el contraste óptico en la medición diagnóstica de tejidos neoplásicos .
1.3. Pruebas y tratamiento cervical
El procedimiento estándar para el diagnóstico del cáncer de cuello uterino en los Estados Unidos incluye la citología líquida (prueba de Papanicolaou) y las pruebas de ADN para el VPH de alto riesgo. Se realizan colposcopias, biopsias y confirmación histológica si se obtienen resultados anormales. Este procedimiento, sin embargo, requiere un alto nivel de estándares de calidad, como personal capacitado, cobertura médica y visitas de seguimiento. Por lo tanto, la Organización Mundial de la Salud (OMS) recomienda un enfoque de detección y tratamiento, donde la prueba de detección primaria debe ser la detección del ADN del VPH cada cinco a diez años después de los 30 años .
Debido a recomendaciones anteriores, las prácticas actuales de detección incluyen pruebas de VPH, inspección visual con ácido acético (IVAA) y citología, todo seguido de tratamiento. Otra opción de detección comúnmente utilizada es la inspección visual con yodo de Lugol (VILI), aunque la OMS no lo recomienda explícitamente. Algunas de las prácticas mencionadas anteriormente no se pueden utilizar en la población general; por ejemplo, la prueba de IVAA no es apropiada para mujeres mayores de 50 años, ya que la zona de transformación (donde generalmente comienzan las lesiones) se mueve hacia el canal endocervical después de la menopausia. La elección de las técnicas de cribado depende en gran medida de los recursos locales, aunque las últimas recomendaciones de la OMS recomiendan encarecidamente el cambio de los métodos mencionados anteriormente al cribado del ADN del VPH debido a la objetividad de la prueba.
1.3.1. Pruebas de ADN del VPH, citología, colposcopia y biopsia
La detección del cáncer de cuello uterino en los Estados Unidos consta de múltiples etapas. Las pruebas conjuntas de ADN del VPH y la citología (o prueba de Papanicolaou) son los primeros pasos para cada diagnóstico de cáncer de cuello uterino. Se inserta un espéculo en el canal vaginal para recolectar células del cuello uterino. Las células se analizan en busca de anomalías y cambios aparentes. Los resultados de la citología son difíciles de puntuar ya que se ha demostrado que hay una baja concordancia interobservador. Stoler et al. encontraron solo un 47,1% de acuerdo en la interpretación de HSIL para los resultados de citología al comparar el diagnóstico original con un grupo de control de calidad.
La prueba de ADN del VPH determina la presencia de VPH de alto riesgo con una especificidad y precisión del 55,6% y el 75,8%, respectivamente, y un valor predictivo positivo del 84,8%
Un segundo paso en la prueba de detección cervical es la colposcopia cuando se encuentran células anormales (es decir, prueba de Papanicolaou positiva). La colposcopia es una inspección visual realizada por médicos capacitados con un colposcopio (un microscopio clínico con un aumento de 3 a 15 veces) que permite observar más de cerca el cuello uterino. La precisión de este procedimiento depende en gran medida del nivel de capacitación y la experiencia de los médicos. Se ha informado que el valor diagnóstico de la técnica tiene una alta sensibilidad (85%). Aún así, baja especificidad (69%), lo que significa que se puede encontrar la ubicación anormal, pero la gravedad de la lesión a menudo es inexacta .
Además, la variabilidad interobservador para los datos colposcópicos tiene un valor kappa de 0,40.
Como parte de la colposcopia, generalmente se realiza una biopsia en la que se toma una muestra de una pequeña porción del cuello uterino. Al igual que la citología, las biopsias tienen una baja concordancia interobservador. Un estudio sobre 2237 histologías cervicales mostró que la concordancia entre el patólogo original y el grupo de control de calidad se superpuso solo el 42,7% de las veces para los casos de CIN1.
1.3.2. Inspección visual
La IVAA consiste en aplicar una solución de ácido acético al 3-5% al ectocérvix. Esta aplicación convertirá las células anormales en el epitelio a un color blanco opaco (denominado acetoblanco) y el tejido se considera VIA positivo. Estas lesiones acetoblancas se deben a la coagulación de proteínas en las células con ácido acético, ya que el tejido neoplásico tendrá un mayor contenido de proteínas que el tejido normal. El valor predictivo positivo de la IVAA es del 16,7% y el valor predictivo negativo del 99%. La especificidad y la sensibilidad son del 79,4% y el 71,8%, respectivamente.
Estos resultados se traducen en muchos falsos positivos que conducen a un sobrediagnóstico y sobretratamiento.Otra técnica de inspección visual, VILI, consiste en aplicar yodo de Lugol en el epitelio cervical. Esta solución reacciona con el glucógeno en el tejido sano normal y se vuelve negra al exponerse. En presencia de tejido neoplásico, el glucógeno se reduce o está ausente, y la solución vuelve amarillo el epitelio. El valor predictivo positivo de VILI es del 16,8% y el valor predictivo negativo del 99,7%, lo que resulta en muchos falsos positivos. La especificidad y sensibilidad de VILI son del 86% y 88%, respectivamente.
La inspección visual para el cribado cervical adolece de baja reproducibilidad y da lugar a variaciones en función de la subjetividad de la interpretación de los resultados.
También se ha demostrado que la edad, la paridad, la menopausia y la presencia del VPH pueden influir en el resultado de las pruebas de inspección visual y en el nivel de formación de los profesionales sanitarios.
Sin embargo, el bajo costo y los resultados en tiempo real de las pruebas de inspección visual lo hacen ideal para entornos de bajos recursos y el enfoque de detección y tratamiento, especialmente en áreas de alta incidencia de cáncer de cuello uterino y bajos recursos médicos .
Para superar los problemas actuales de detección utilizando VIA y VILI, se necesita una mejor capacitación del personal sanitario. Además, Raifu et al. recomiendan específicamente una mejor capacitación del personal sobre la definición e interpretación de las lesiones acetoblancas del epitelio cervical en estos entornos
1.3.3. Tratamientos
Los tratamientos recomendados para la neoplasia cervical están dirigidos a eliminar o destruir la zona de transformación y las áreas anormales que se encuentran en el cuello uterino. Dos vías principales de tratamiento incluyen la ablación y la escisión (aunque hay investigaciones en curso para tratamientos alternativos).
Usando el tratamiento ablativo, el tejido anormal se destruye calentándolo a través de la coagulación térmica o congelándolo mediante crioterapia. La vía de escisión elimina el tejido mediante la escisión con asa grande de la zona de transformación (LLETZ) o mediante el cono de cuchillo frío (CKC), también conocido como conización del cuello uterino.
1.4. Vacunas contra el VPH
Ha habido tres vacunas contra el VPH disponibles desde 2006, aunque actualmente solo una se usa en los Estados Unidos. Gardasil 9 es una vacuna 9-valente que se dirige a los tipos de VPH 6, 11, 16, 18, 31, 33, 45, 52 y 58. La vacuna tiene una eficacia cercana al 100% para adolescentes jóvenes de 9 a 15 años.
La vacuna se dirige a infecciones en áreas anatómicas distintas del cuello uterino (por ejemplo, vulva, pene, ano). Aunque la vacunación contra el VPH ha reducido el número de infecciones en las mujeres desde su introducción, no cubre los 15 tipos de VPH de alto riesgo.
Además, es costoso y difícil de implementar en los países en desarrollo, dejando la detección y el tratamiento de lesiones precancerosas como los principales métodos preventivos .
La lenta progresión del cáncer de cuello uterino, la accesibilidad anatómica y el posible tratamiento de las lesiones precancerosas hacen que el cribado precoz sea un tratamiento eficaz .
Debido a los altos costos de los procedimientos tradicionales de detección cervical, se han desarrollado varios dispositivos para aumentar el acceso a las pruebas cervicales en entornos de bajos recursos.